动态与文件
大洗牌时代,药企该如何提高生物等效性试验通过率?
2017-09-03 18:39:30 浏览:589
随着国家仿制药一致性评价工作紧锣密鼓的推行,
医药企业将面临重新洗牌的危机,
一致性评价政策如何深刻解读?
BE试验周期太长花费巨大成功率低,
一直困扰着广大医药研发人员
现如今在仿制药政策趋紧与创新药政策利好的风向下,由中国化学制药工业协会及商图信息BMAP共同举办,美中医药开发协会(SAPA)支持的PharmaCon 2017 第三届中国国际化学药仿创开发论坛作为行业内的年度品牌峰会,的于2017年10月19-20日上海宝龙**盛大开启!
9月20日下午五点前报名,即享早期优惠价格
本届已确认演讲嘉宾(部分)

论坛亮点
- 追踪国内外生物等效性实验等仿制药一致性评价的最新政策、法规与指南动态
- 交流不同剂型在仿制药一致性评价中的全程案例研究与经验
- 讨论溶出实验、IVIVC、生物等效性试验方案设计,提高生物等效性试验通过率
- 学习领先企业在2类新药、505b2新药申请的法规与开发的最新动态
- 探索仿创药物开发战略,差异化布局创新给药途径及制剂,突破化药创新
参会人群
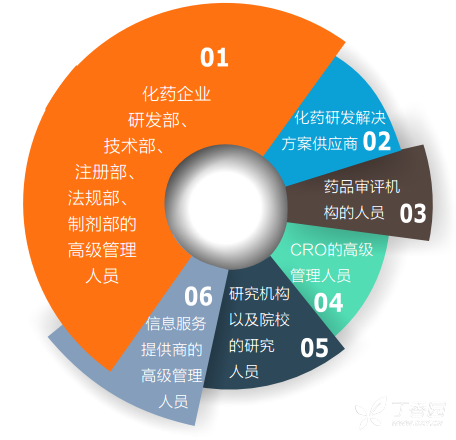
PharmaCon2017设置两大论坛并行,由第三届中国国际化学药仿创开发论坛和医药生产与质量管理论坛两个分论坛组成,将汇聚400多位国内研发与生产质量管理高层,热点议题贯穿从研发到批次生产的生命全周期。
论坛同期有少量赞助席位,名额有限,立刻锁定您的宣传市场机会!
联系组委会
联系电话:+86 021-6052 9512
邮箱:pharmacon@bmapglobal.com
网址:www.bmapglobal.com/pharmacon2017
同期论坛 医药生产与管理论坛
十三五”医药行业在生产需求变化调整,企业需进一步保证整个生产工艺流程和质量体系的可控。基于药品生产及质量管理方面存在挑战,在此背景下,PharmaCon 2017 医药生产与管理论坛通过精心行业调研,内容与时俱进.
将汇聚行业内质量和生产部门负责人就大家最为关注的上市许可人制度、计算化系统验证、数据可靠性、GMP科学监管、绿色环保、清洁验证及无菌生产, 解析生产工艺放大过程中的难点与应对思路,确保产品最终质量,分享如何在实现GMP合规下,进行智能、绿色、低成本生产等热点话题进行探讨,从而提高企业的生产与质量管理效率以及药品质量。
本届已确认演讲嘉宾
- 潘广成,中国化学制药工业协会执行会长
话题:十三五规划解读与医药合规
简介:历任卫生部医疗器械局干部、处长,国家医药管理局人事司处长、副司长、政策法规司司长,中国医疗器械工业公司副总经理,中国医药集团总公司董事会秘书,现任中国化学制药工业协会执行会长。
- 张霁,首席科学家,广东东阳光药业
国家“千人计划”特聘专家,先后任职于美国雅培药业(Abbott), 辉瑞药业(Pfizer)全球研发密歇根研发中心和百时美施贵宝制药(Bristol-Myers Squibb), 先后担任药物研发化学家、资深科学家、研究员和首席科学家
- 李永国, 华领医药药物生产和监管副总裁
现任华领医药药物生产和监管副总裁,主要负责创新药的药学研究,药学注册资料撰写,临床用药供给,GxP (GMP,GLP和GCP)质量监管,以及项目管理等。曾任罗氏研发(中国)有限公司分析部总监,药学部副负责人,研发中心资深管理团队成员。具有22年的医药企业和学术机构的创新药物的研究与开发的经验
话题:MAH制度下,委托生产和质量控制先关注意事项
- 吴振平, 和记黄埔医药资深副总裁,药学
生物医药领域拥有21年的药物研发经验,领导过多个项目的研发团队,将多个新药候选药物推进至临床各个阶段和市场,包括舒尼替尼
话题:杂质在化药批次放大开发中的控制策略
- 钟丽君,人福医药质量副总裁
话题:医药生产中CAPA系统的应用
简介:多年医药生产与质量管理工作经验,熟悉QA和QC管理以及制药企业研、产、销管理流程及政策法规。
- 叶存孝,华海药业副总经理、质量授权人
30多年在国企、外资、民企从事制剂、原料药质量控制及质量管理工作,包括在杭州默沙东制药有限公司8年和西安杨森制药有限公司3年质量部工作经历
话题:生产工艺一致性的研究
- 沈菊平,南京圣和药业有限公司副总经理
丰富的中国 GMP、欧盟GMP和日本GMP等检查和认证的经验,并有许多成功案例。对药品的生产、质量、设备、验证和工艺有非常丰富的理论知识和实践经验,特别是无菌药品。
话题:无菌生产线模拟灌装试验的要点
- 刘树林,华北制药质量总监
话题:医药生产中污染监控与防范策略,无菌药品生产质量的监控,防止生产过程中的污染和交叉污染
论坛亮点
- 追踪最新药品生产中MAH制度、计算机系统验证、数据管理的法规动态
- 学习领先药厂在计算机化系统验证以及数据可靠性在生产中的最佳应用
- 探索领先企业在中外GMP体系下的质量管理、过程控制与清洁验证、风险控制的优秀实践
- 解析生产工艺放大过程中的难点与应对思路 ,确保产品最终质量
- 分享如何在实现GMP合规下,进行智能、绿色、低成本生产
9月20日之前报名将享早期优惠价格!
重要日期
-
会议日期
10月19日
2017
至10月20日
2017
-
10月20日 2017
注册截止日期
主办单位
bmap
承办单位
联系方式
- Miss BMAPBMAP
- el******@bmapglobal.com
- 188********
- Miss 王瑞
- je******@bmapglobal.com
- 188********

